I. 서 론
II. 커버슬립형 초음파 변환자 제작 및 실험 방법
2.1 초음파 변환자 구조 설계 시뮬레이션
2.2 압전 소자 제작
2.3 초음파 변환자 출력 측정
2.4 별세포 칼슘 이미징 및 초음파 자극
III. 초음파 자극에 따른 별세포 칼슘 반응
IV. 결 론
I. 서 론
저강도 집속 초음파 뇌 자극 기술은 수 백 킬로헤르츠부터 수 메가 헤르츠 범위의 주파수를 가지는 초음파 신호를 뇌 특정 부위에 집속시켜 기계적인 자극을 수행하여 뇌 기능의 변조를 일으킬 수 있으며, 이를 통하여 뇌 기능 저하와 관련된 질병을 치료하는데 적용되어왔다.[1,2,3] 최근, 초음파 뇌 자극술을 이용하여 알츠하이머병, 우울증, 간질 등과 같은 치명적인 뇌 질환에 대한 치료 효과가 보고되고 있어 자극술의 임상에의 적용에 대한 가능성을 보여주고 있다.[4,5,6] 또한, 최근 발표된 논문에 따르면, 초음파 자극을 통해 뉴런을 활성화 시키는 경우에는 비교적 높은 강도의 초음파 자극을 필요로 하고, 신경 세포 중 하나인 별세포를 자극 하기 위해서는 저강도 집속 초음파를 이용해야한다는 연구가 발표 되었다.[7,8] 이렇게 초음파 뇌 자극의 효과는 초음파 주파수, 강도, 초음파 자극의 길이 및 자극 반복 주기와 같은 요소들을 반영하여 만들어 낸 초음파 자극의 종류에 따라서 달라지는데, 지금까지의 연구에서는 주로 동물을 대상으로 실험적으로 초음파 자극의 종류를 다변화 하여 최적의 조건을 찾는 방법으로 진행되었다. 그러나, 이렇게 실험적으로 여러 가지 자극 조건을 시도해 보면서 최적화된 초음파 자극의 종류를 찾는 방법은 개체에 따라 달라질 수 있으며, 이에 따라 도출된 초음파 자극이 실제로는 세포를 손상시킬 수 있는 조건이 될 수도 있는 한계점을 가지고 있다.[9,10] 이를 개선하기 위해서는 세포 수준의 기전 연구를 선행하여 자극의 종류에 따른 뇌 세포 반응의 원리를 이해해야 하지만, 이러한 실험을 수행할 환경이 제한되어 있다. 지금까지 뇌세포를 배양하여 초음파 자극에 대한 반응을 관찰했던 시스템은 크게 두 가지로 나뉘어진다. 첫 번째, 세포 배양용 유리 커버슬립 표면에 뇌세포를 배양한 후 외부 초음파 변환자를 사용하여 커버슬립 표면으로 또는 아래로부터 초음파 자극을 가하거나, 비교적 초음파 투과에 용이한 마일러 필름 표면에 세포를 배양하여 외부 초음파 변환자를 사용하여 자극을 전달하는 방법이 있다.[7] 이러한 방법은 많은 연구자들이 접근하기 쉬운 방법이지만, 외부 초음파 변환자를 통해 발생한 초음파가 유리커버슬립을 투과할 때 많은 초음파 감쇠가 발생하며, 초음파 신호가 커버슬립으로 진행할 때 커버슬립 내부에서 발생하는 반사 효과 때문에 자극 신호의 왜곡을 불러올 수 있다.[11] 마일러 필름의 경우, 초음파에 대한 투과도가 높다 하더라도, 필름의 기계적인 움직임이 발생할 수 있을 뿐만 아니라 균일한 초음파 자극을 다수의 세포에 전달하는데 있어 제한이 있다. 이를 극복하기 위해 두 번째 세포자극시스템의 형태는 압전 초소형 초음파 변환자(piezoelectric Micromachined Ultrasonic Transducer, pMUT) 기술을 이용하여 뇌세포 자극에 용이한 변환자를 평판 형태로 제작한 후 뇌세포를 배양한 유리커버슬립을 초음파 변환자와 마주보도록 뒤집어 배치한 구조로, 다량의 뇌세포에 균일한 자극을 전달할 수 있는 시스템이 제작되었다.[12] 하지만 이와 같은 시스템에서도 유리커버슬립에 뇌세포를 배양하였기 때문에 커버슬립 내부 반사와 더불어 변환자와 커버슬립 사이에 형성되는 정상파로 인해 의도하는 초음파 자극의 종류를 정밀하게 뇌세포에게 전달하기 어렵다는 단점이 있다. 따라서, 뇌세포 자극에 대한 초음파 반응을 세포 수준에서 연구하기 위해서는 왜곡이 최소화된 초음파 자극을 다량의 세포에 전달하고, 자극이 진행되는동안 세포의 반응을 실시간으로 관찰할 수 있는 시스템이 필요하다.
따라서, 본 논문에서는 세포배양 기능과 초음파 변환자 기능이 결합된 커버슬립형 초음파 변환자를 세포 수준 초음파 자극 기기로 제안하고자 한다. Poly-vinylidene fluoride-trifluorethylene(PVDFTrFE)를 압전 소자를 커버 글래스 위에 스핀 코팅 하고 그 위에 생체 적합성이 높은 물질로 알려진 패를린 층을 코팅함으로써, 세포를 패를린 층 위에 배양 가능하도록 설계하였다. 또한, PVDF-TrFE는 폴리머 소재의 압전 소자로써, 다른 압전 소자에 비해 음향 임피던스가 낮고 광대역의 특성을 보여주므로 주파수 변화에 따른 세포의 반응을 관찰할 수 있을 것으로 기대할 수 있다. 이러한 세포배양-초음파 변환자 일체형구조를 가진 장치를 사용하여 저강도 초음파 자극에 반응하는 것으로 알려져 있는 많은 양의 별세포에 균일한 초음파 자극을 가할 수 있도록 하였고, 초음파 흡음재를 변환자 둘레에 설치함으로써 정현파에 의한 초음파 자극의 왜곡 현상을 보정할 수 있었다.[8] 또한, 초음파 자극을 뇌세포에 전달하는 동시에 공초점 현미경을 이용하여 세포의 칼슘 반응을 확인하여, 초음파 자극에 뇌세포가 반응함을 확인하였다.
II. 커버슬립형 초음파 변환자 제작 및 실험 방법
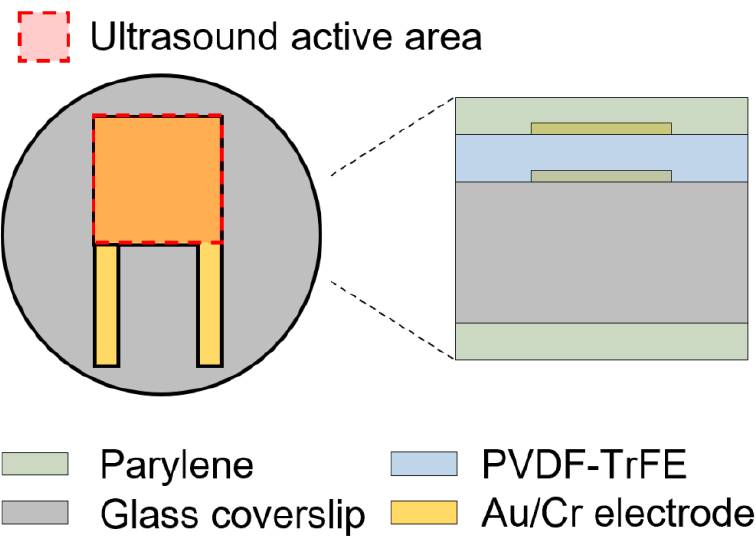
커버슬립형 초음파 변환자는 유리 커버슬립 표면에 전극을 형성하고 폴리머 압전소자(PVDF-TrFE)를 스핀 코팅으로 압전 소자 층을 형성 후 압전 소자 위에 전극층과 절연층을 생성하여 제작된다(Fig. 1). 이 때, 압전소자의 양단에 접착된 전극에 신호선과 접지선을 구분하여 연결하기 위해 전극의 모양이 대칭적으로 반대가 되도록 설계하였다.
2.1 초음파 변환자 구조 설계 시뮬레이션
효과적으로 별세포를 자극하기 위해서,[8] 초음파 변환자의 크기 및 압전 소자의 두께를 시뮬레이션 소프트웨어(PiezoCAD, Sonic Concepts)를 이용하여 최적화하였다. 시뮬레이션에서 사용된 유리, 압전 소자, 패를린의 음향 변수는 Table 1과 같다.
Table 1.
Acoustic parameters of materials used in ultrasonic transducer.
| Material | ρ (kg/m3) | VL (m/s) | VS (m/s) | Z (MRayls) |
| Glass | 2,500 | 5,660 | 4,002 | 14.15 |
| PVDF-TrFE | 1,880 | 2,400 | 1,200 | 4.512 |
| Parylene | 1,357 | 2,100 | 1,485 | 2.85 |
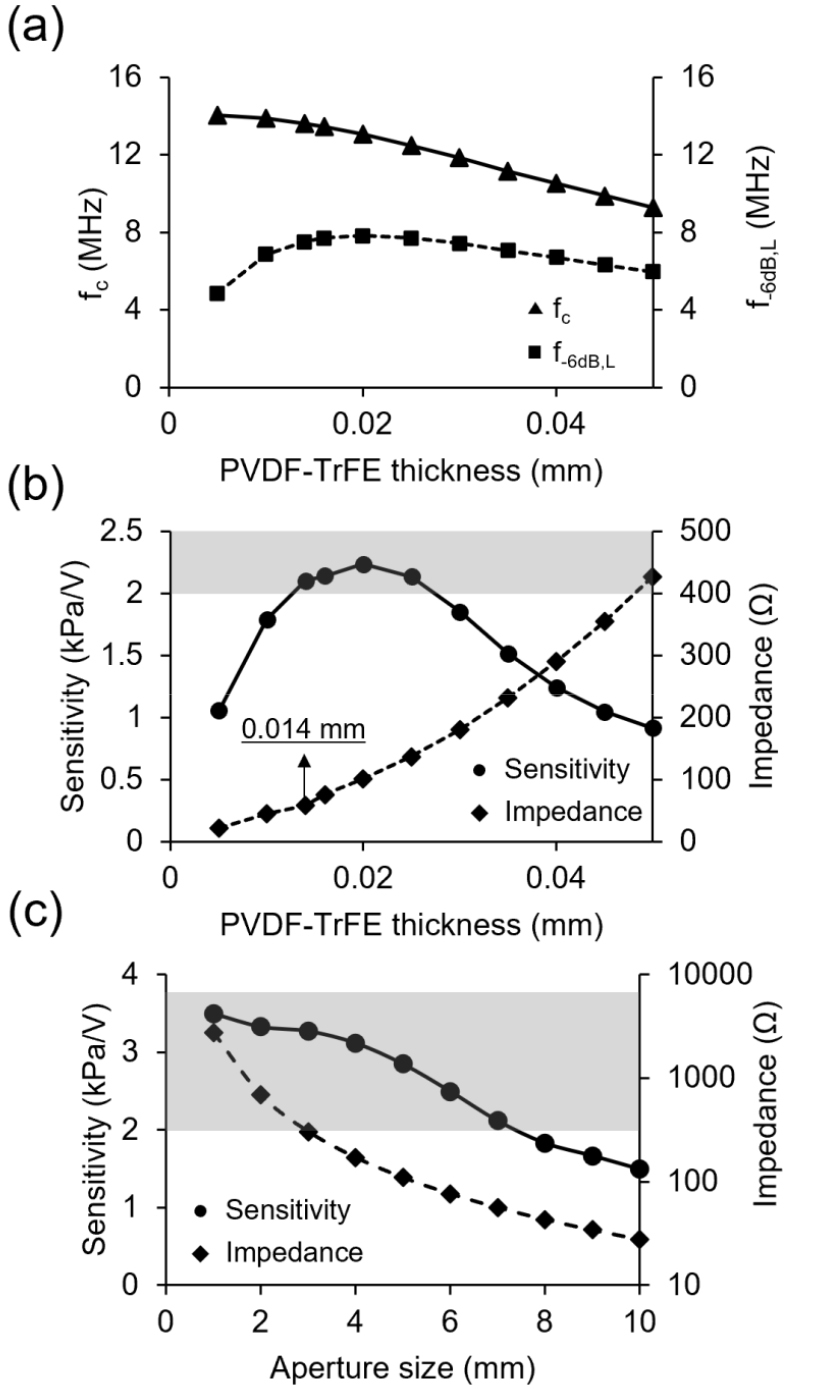
별세포를 효과적으로 자극하기 위해서, 초음파 변환자는 낮은 주파수의 초음파를 세포에 전도할 수 있어야 하고, 높은 민감도 특성을 바탕으로, 200 kPa 이상의 음압을 생성할 수 있어야 한다.[13] 따라서, PVDF-TrFE의 두께를 0.005 mm부터 0.05 mm까지 증가시키면서 변환자의 중심 주파수(fc), -6 dB 대역폭 내 가장 낮은 주파수인 f–6dB, L, 민감도(Sensitivity) 및 전기 임피던스(Impedance)를 계산하였다. 결과적으로, PVDF-TrFE 두께가 얇아짐에 따라서, 중심 주파수는 증가하였고, f–6dB, L는 0.005 mm에서 가장 낮고, 0.02 mm에서 가장 높았다[Fig. 2(a)]. 기존 연구 Duque et al.[14]에 따르면, 초음파 자극에 반응하는 Transient Receptor Potential cation channel, subfamily A1(TRPA1) 채널은 7 MHz의 초음파 자극에 가장 민감하게 반응한다고 알려져 있고 TRPA1은 별세포에 다량으로 발현되어 있으므로, 효과적으로 별세포를 자극하기 위해서는 7 MHz의 초음파 자극을 전도해야한다. Fig. 2(a)에 따르면, PVDF-TrFE는 넓은 대역폭 특성을 가지기 때문에, 0.005 mm부터 0.05 mm 의 두께 모두에서 해당 주파수를 생성할 수 있다. 또한, 100 V의 전압을 변환자에 전달할 때 200 kPa의 음압을 생성하기 위해서는 변환자가 2 kPa/V 이상의 민감도를 가져야 하는데 Fig. 2(b)에 따르면, 변환자는 PVDF-TrFE의 두께가 0.014 mm부터 0.025 mm 사이에서 2 kPa/V 이상의 민감도를 가진다. 추가적으로, 전기 신호를 초음파 신호로 가장 효과적으로 변환하기 위해서는 변환자의 전기 임피던스가 50 Ω에 가까워야 하므로 가장 적절한 PVDF-TrFE의 두께는 0.014 mm이다[Fig. 2(b)].
다음으로, 변환자의 크기를 결정하기 위해서, 크기를 1 mm부터 10 mm까지 증가시키면서 변환자의 민감도 및 전기 임피던스를 계산하였다. 결과적으로, Fig. 2(c)에 따르면, 민감도와 전기 임피던스는 변환자의 크기가 증가함에 따라 감소함을 보였으나, 2 kPa/V 이상의 민감도를 갖는 변환자의 크기는 1 mm부터 7 mm였다. 그러나, 해당 변환자의 크기 중 전기 임피던스가 50 Ω에 가장 근접한 변환자의 크기는 6 mm였기 때문에, 변환자의 크기는 6 mm로 결정하였다.
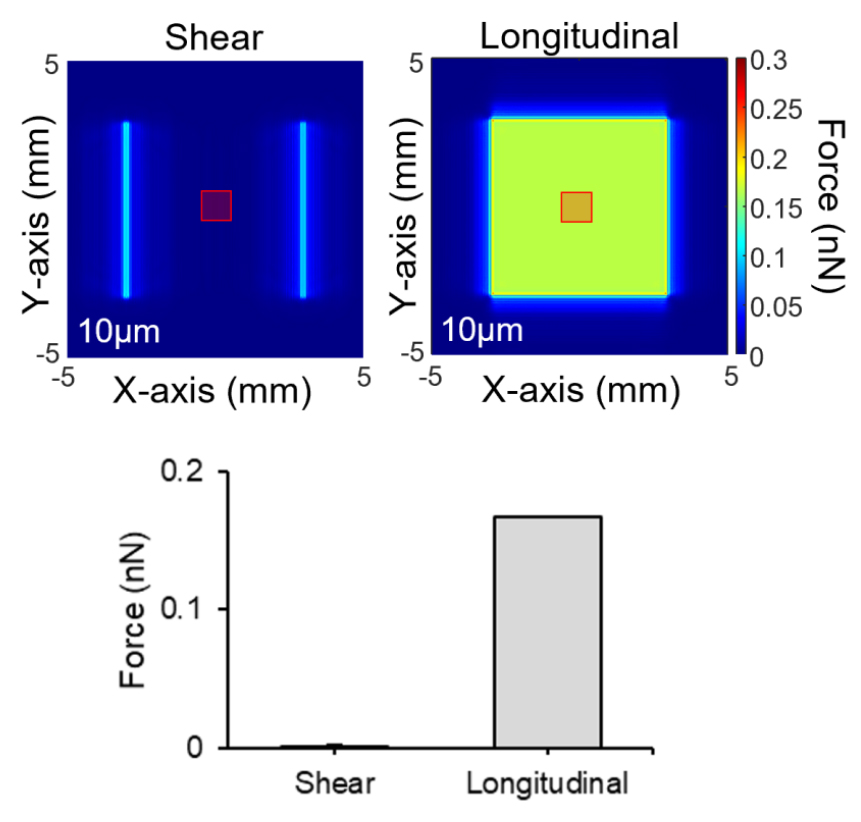
또한, 해당 변환자에서는 세포가 변환자 표면에 배양되기 때문에, 세포가 종 방향으로의 초음파 신호에 의한 자극 뿐만 아니라 횡 방향의 초음파 신호에 의해서 자극 될 수 있는 가능성이 존재한다. 따라서, 3D 모델링 소프트웨어(Solidworks, Dassault Systems)를 이용해 모델링한 변환자를 컴퓨터 시뮬레이션 소프트웨어(Pzflex, Weidlinger Associates)를 통해 변환자 표면으로부터 10 μm 떨어진 평면에서의 종 및 횡 방향의 힘을 계산하였다. 결과적으로, 6 MHz를 가진 1 cycle, 100 Vpp의 전기 신호를 변환자에 전달하였을 때, 빨간 지역(1 mm × 1 mm)에서 종 방향 힘의 평균값이 횡 방향 힘의 평균값 보다 100배 이상 강한 것을 확인하였다(Fig. 3).
2.2 압전 소자 제작
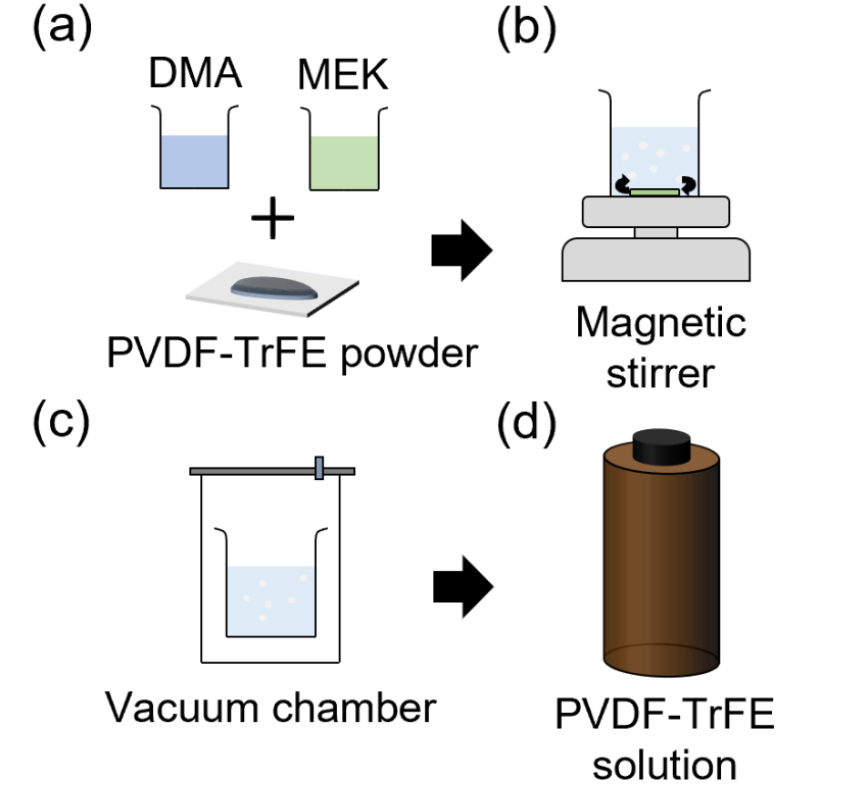
PVDF-TrFE 용액을 제작하기 위해, Fig. 4(a)에서 보여주는 바와 같이 분말 형태의 PVDF-TrFE(10 g, FC-20, Arkema)를 Dimethylacetamide(DMA, 16 g, 271012, Sigma-Aldrich)와 Methyl ethyl ketone(MEK, 36 g, 63140-1230, Junsei) 혼합 용액에 용해시킨다. DMA, MEK, PVDF-TrFE를 용해시킬 때, 삼각플라스크에 PVDF-TrFE, DMA, MEK 순서로 넣어서 용해한다. 혼합된 용액을 24 h 동안 자기 교반기(MS500, Daihan Scientific)를 통해 균일하게 섞어 주면서 PVDF-TrFE 입자들을 모두 용해시킨다[Fig. 4(b)]. 용해가 끝난 후, 진공 챔버에 5분간 두고 용액 속의 공기방울들을 제거한 후 보관한다[Fig. 4(c)]. 완성된 PVDF-TrFE 용액은 수분에 취약하므로 반드시 냉장 보관을 한다[Fig. 4(d)].
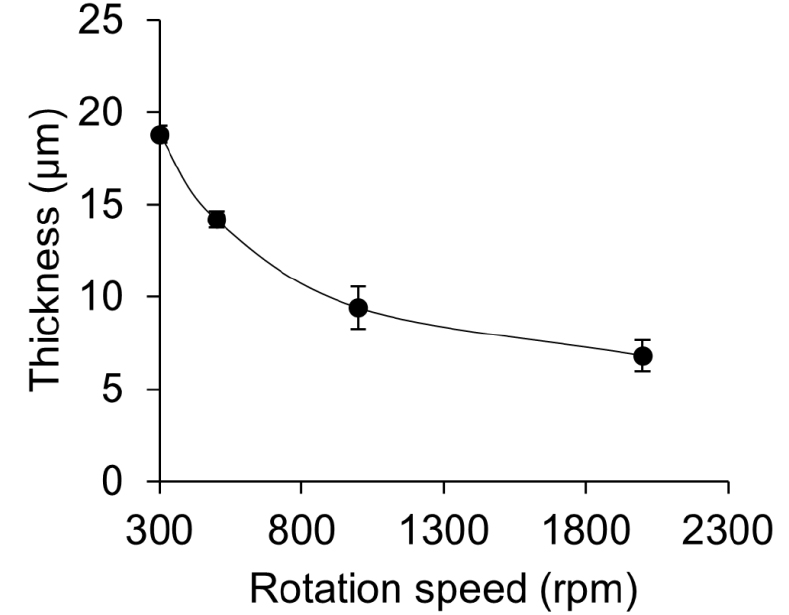
제조된 용액에 대해, 스핀 속도에 따른 PVDF-TrFE 필름의 두께에 대한 정보를 획득하기 위해, PVDF-TrFE 용액을 스핀 코터(ACE200, Daihan Scientific)에 부착된 커버글래스 표면에 붓고, 30 s 동안 300 rpm부터 2,000 rpm로 회전 속도를 증가시키면서 각 회전속도에 해당하는 PVDF-TrFE 필름의 두께를 측정하였다. Fig. 5에서 보여주듯이, 스핀 코터의 회전 속도를 높힐수록 PVDF-TrFE의 두께는 지수적으로 앏아짐을 확인하였으며, Eq. (1)에 근사하였다. y는 PVDF-TrFE 두께, x는 회전 속도이다.
제작한 PVDF-TrFE 용액을 이용하여 초음파 변환자 제작에 앞서 지름 25 mm의 유리커버슬립의 표면을 청소하는 과정을 거친다. 면봉을 이용하여 아세톤(67-64-1, Samchun Pure Chemical), 알코올(64-17-5, Samchun Pure Chemical), 계면활성제(1104-1, Alconox) 순서로 커버슬립 표면을 세정한 후 흐르는 증류수 1 L를 표면에 천천히 부으면서 남아있는 계면활성제를 제거해 준다[Fig. 6(a)]. 커버슬립 표면 위에 초음파 변환자의 한쪽 전극을 형성하기 위해, Fig. 1에서 보는 바와 같이 국자 모양의 패턴을 캡톤 테이프를 커버슬립 표면에 부착하여 구현한다[Fig. 6(b)]. 캡톤 테이프를 부착한 채로 유리 표면과 전극 간의 부착력을 향상시키기 위해 플라즈마 클리너(PDC-002-HP, Harrick Plasma)를 이용한 표면 처리를 수행한다. Ar 기체를 30 sccm 농도로 주입하면서 플라즈마 처리를 30 min 동안 수행한 후, 마그네트론 스퍼터(Flexlab-50, A-Tech System)를 이용하여 금/크롬 전극을 증착한다[Fig. 6(c)]. 금 전극이 증착된 샘플의 캡톤 테이프를 제거하는 방법으로 국자 패턴의 아래 전극 증착이 완성된다[Fig. 6(d)], 아랫 전극이 증착된 커버슬립을 스핀 코터(ACE200, Daihan Scientific)의 샘플 로더에 부착하고, 기 제조한 PVDF-TrFE 용액을 샘플 표면에 일정량 붓고 14 μm 두께의 필름 형성을 위해, 500 rpm의 속도로 30 s 동안 회전시킨다. 얇게 코팅된 PVDF-TrFE 막은 상온에서 불균일하게 건조해지므로, 거품으로 인한 파인 표면을 최소화한 평평하고 균일한 PVDF-TrFE 필름을 만들기 위해, 스핀코팅 후 곧바로 순환식 건조기(SH-DO-100FG, SH Scientific) 내에서 75 °C의 온도로 30 min 동안 건조시킨 후 135 °C의 온도로 2 h 동안 추가로 건조시킨다[Fig. 6(e)]. 상단 전극을 증착하기 전에 하단의 국자 모양 전극이 뒤집어진 형태의 모양을 제작하기 위해, 전극이 증착되지 않아야 하는 지역에 Kapton tape로 마감한다. 스퍼터 증착 전 PVDF-TrFE와 전극 사이의 접착력을 높이기위해 아르곤 플라즈마 표면 처리를 한다[Fig. 6(f)]. 이후 하단 전극과 같은 방식으로 금/크롬 전극을 증착한다[Fig. 6(g)]. 전극 증착을 완료한 후, 캡톤 테이프를 제거하고 상단 전극 패턴을 완성시킨다[Fig. 6(h)]. 초음파 변환자에 입력 전압을 가하기 위해서 전선을 금 전극에 납땜으로 연결한다. 아랫 전극과 전선을 연결할 때, 납땜을 진행할 부분의 PVDF-TrFE를 면도칼(DN52, Dorco)을 이용하여 일부 제거한 후 납땜을 통해 전선과 연결시킨다[Fig. 6(i)-(j)]. 이렇게 완성된 변환자에 강압전성을 부여하기 위해서 105°C의 환경에서 80 V/μm의 직류 전압을 20 min 동안 가해준다[Fig. 6(k)]. 마지막으로, 초음파 변환자의 출력을 극대화하고 방수 기능 및 생체 적합성을 높이기 위해서 패를린 코터(OBT-PC200, Obang Technology)를 이용하여 12 μm 두께의 패를린을 적층하였다[Fig. 6(l)].
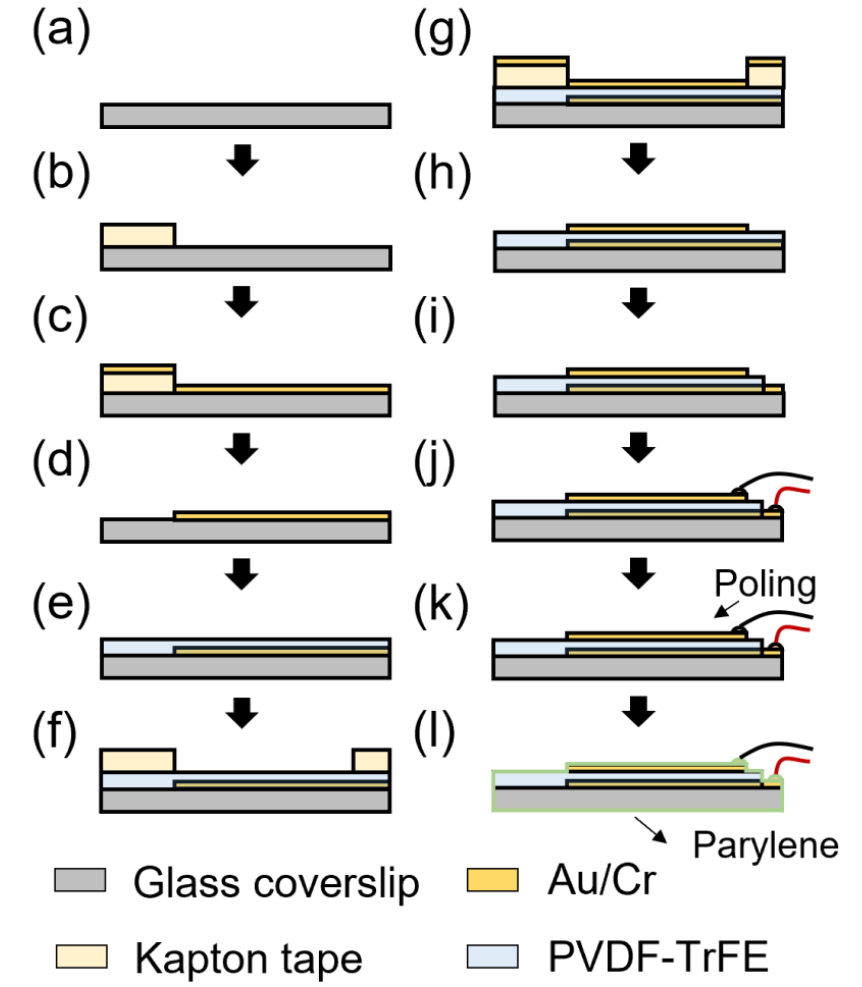
Fig. 6.
(Color available online) Ultrasonic transducer fabrication protocol. (a) Prepare glass coverslip. (b) Masking glass coverslip with Kapton tape. (c) Deposit gold/chromium electrode above the Kapton tape. (d) Detach the Kapton tape. (e) Spin-coat the PVDF-TrFE. (f) Applying Kapton tape to patterning the top electrode on the surface of PVDF-TrFE. (g) Deposit gold/chromium electrode. (h) Detach the Kapton tape. (i) Remove the portion of PVDF-TrFE layer to wiring the electrode with coaxial cable. (j) Soldering between electrode and coaxial cable. (k) Applying direct-current high-voltage to poling the ultrasonic transducer. (l) Coating parylene layer around the transducer.
2.3 초음파 변환자 출력 측정
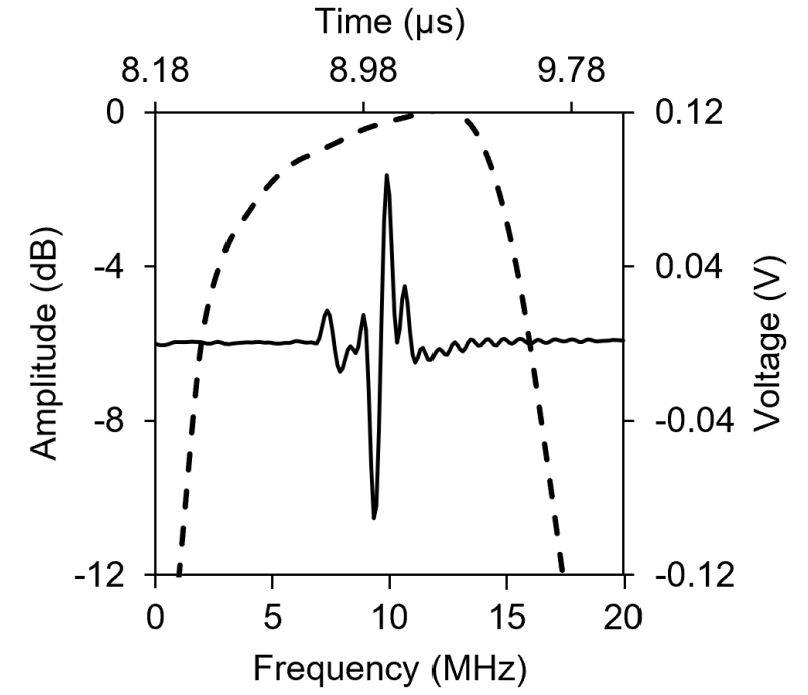
커버슬립 초음파 변환자의 중심 주파수와 대역폭을 측정하기 위해, 펄서-리시버(UT 340, UTEX Scientific) 를 사용하여 펄스-에코 측정 실험을 수행하였다. 초음파 변환자의 주파수 응답 반응을 획득하기 위하여 100 V의 전압과 2 ns의 펄스 폭을 가진 매우 짧은 전압을 변환자에 전도하였다. 펄스-에코 측정 실험은 증류수가 담긴 수조에서 진행되었으며, 지름 5 cm, 두께 15 mm 유리 재질의 초음파 반사판은 변환자의 초점거리인 변환자 표면으로부터 36 mm 지점에 설치되었다. Fig. 7에서 보여지듯이, 100 V, 2 ns의 임펄스 신호를 변환자에 전달하였을 때, 중심 주파수는 12.7 MHz였으며, 대역폭은 110 %로 측정되었다.
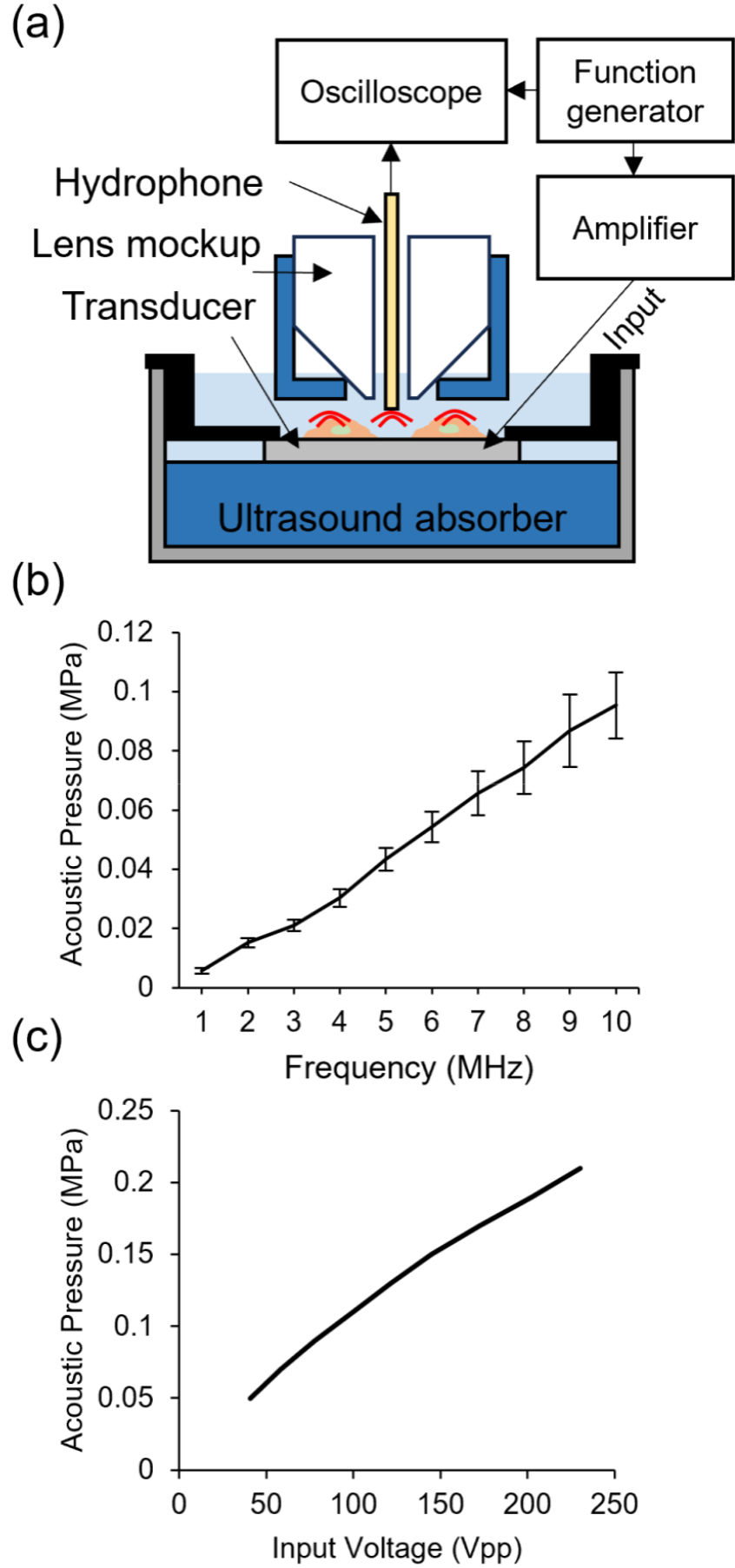
커버슬립 초음파 변환자의 주파수에 따른 음향 출력을 측정하기 위해 10개 변환자의 음향 출력을 주파수 1 MHz부터 10 MHz까지 증가시켜 가며 1 MHz 마다 출력을 측정하였다. 이 때, 초음파 변환자 자극 신호는 100 Vpp의 3개의 사이클을 가진 정현파 버스트(Burst)를 사용하였다. 커버슬립 하단과 초음파 변환자 사이의 반사파에 의한 출력 신호의 왜곡을 줄이기 위해, 0.5 cm 두께를 가진 초음파 흡음재 판 위에 커버글래스 변환자를 올려두고, 바늘형 하이드로폰(NH1000, Precision Acoustics)의 끝을 변환자 위 1 mm 지점에 위치 시켜 출력을 측정하였다. 실제 실험에서 발생하는 초음파 자극의 모양을 측정하기 위해, 현미경 렌즈 형태를 3D 프린팅 하여 제작하고, 중앙에 구멍을 뚫어 Fig. 8(a)에서 보는 바와 같이 바늘형 변환자를 삽입하여 측정하였다. 이 때, 현미경 렌즈 모사체의 표면을 흡음재로 감싸서 렌즈 형태의 표면과 변환자 사이의 정상파 형성을 최소화하였다. 커버슬립 변환자의 음향 출력은 주파수가 증가함에 따라 증가하였으며, 10 MHz에서 최대 음압을 발생시켰다[Fig. 8(b)]. 초음파 뇌세포 자극에 있어, 최대한 낮은 주파수를 사용해야만, 경두개 초음파에서 사용되는 1 MHz 근처의 주파수와 근접하게 되므로, Fig. 8(b)에서 측정된 –6 dB 대역폭의 하단 부분인 6 MHz를 자극 주파수로 설정하였다.[15] 또한, 동일한 환경에서 입력 전압에 따른 초음파 출력 음압을 6 MHz에서 측정하였을 때, 입력 전압이 증가하면서 출력 음압 또한 비교적 선형적으로 증가함을 확인하였다[Fig. 8(c)].
2.4 별세포 칼슘 이미징 및 초음파 자극
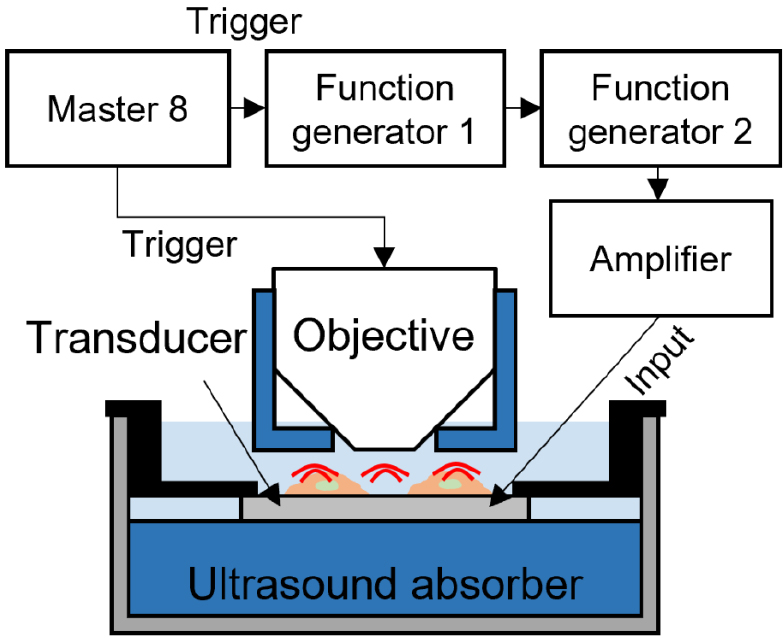
초음파 자극에 의한 별세포의 칼슘 반응을 측정하기 위하여, C57BL/6 로부터 수확한 별세포를 제작한 변환자 표면에 1 ~ 2주일 배양한 다음, 세포 내 칼슘 표지자인 Fluo4-AM(F14217, Thermo Fisher) 1 μM를 이용하여 별세포 내부 칼슘을 표지하였다.[16] 실험을 진행하는 동안 챔버에 HEPES 버퍼(150 mM NaCl, 10 mM HEPES, 3 mM KCl, 2 mM CaCl2, 2 mM MgCl2, 5.5 mM glucose, pH 7.3, 320 mOsmol/kg)로 채워 두었다. 초음파 자극에 대한 별세포 칼슘 반응은 공초점 현미경(LSM880, Carl Zeiss)을 이용하였고 펄스 생성기(Master-8, AMPI)에서 현미경과 초음파 자극을 개시하는 함수 발생기에 동시에 트리거 신호를 전달하여 초음파 자극과 동시에 세포 칼슘 반응을 측정할 수 있도록 하였다. 추가적으로, 초음파 변환자 아랫면 및 현미경 렌즈에서 반사되는 초음파 신호를 최소화 시키기 위하여 변환자 하단과 렌즈에 초음파 흡음재(Aptflex F28, Precision Acoustics)를 설치하였다(Fig. 9). 별세포를 자극하기 위하여 펄스 생성기에서 생성하는 트리거 신호를 첫 번째 함수 발생기에서 수신한 후 1.5 kHz의 펄스 반복 주파수를 가진 3.3 Vpp 전기 신호 750개를 두 번째 함수 발생기로 송신한다. 첫 번째 함수 발생기로부터 생성된 전기 신호를 트리거 신호로 두 번째 함수 발생기에서 받아들인 후, 해당 트리거 신호에 맞추어 6 MHz의 전기 신호 2,010개를 발생시켜 전력 증폭기(350 L, Electronics and Innovation) 로 전달한다. 전력 증폭기는 47 dB의 이득으로 전압을 증폭시켜 변환자로 전달한다. 커버슬립 초음파 변환자에서는 받아들인 전기 펄스 신호를 초음파 신호로 변환하여 500 ms 길이를 가지는 6 MHz의 버스트(Burst)를 1.5 kHz 펄스 반복 주파수로 배양된 별세포에게 전달하여 자극에 따른 세포 반응의 변화를 관찰하였다.
III. 초음파 자극에 따른 별세포 칼슘 반응
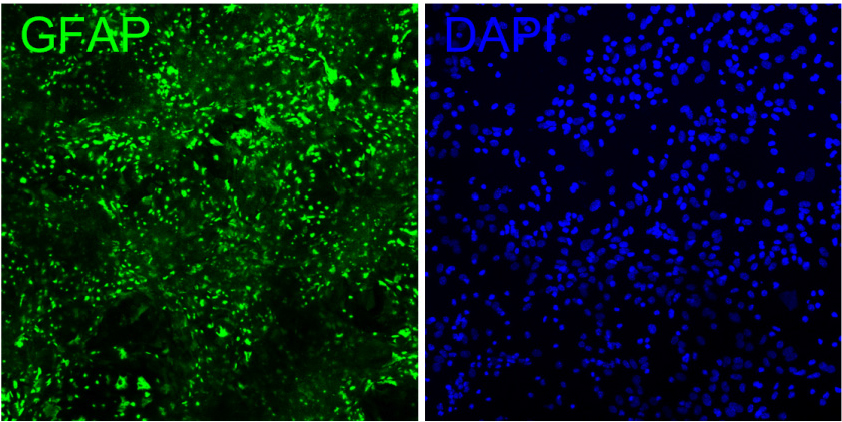
변환자 표면에서의 별세포 배양 가능성을 확인하기 위해, 2주 동안 별세포를 배양하였다. 2주 뒤에 커버슬립 초음파 변환자 위 세포의 생존을 확인하기 위하여, 배양한 별세포를 chicken anti-GFAP(AB5541, Millipore)와 Alexa Fluor 488-conjugated donkey anti-chicken IgY(IgG)(H+L)(703-545-155, Jackson ImmunoResearch Laboratories)를 동시에 사용하여 별세포 표지자인 GFAP, 세포핵 표지자인 DAPI로 별세포와 별세포 핵을 표지하였다. 표지된 세포는 공초점 현미경(LSM 900, Zeiss)을 통해 형광 이미지를 획득하였으며, 초음파 변환자 표면에 정상적으로 잘 성장한 것을 확인할 수 있었다(Fig. 10).
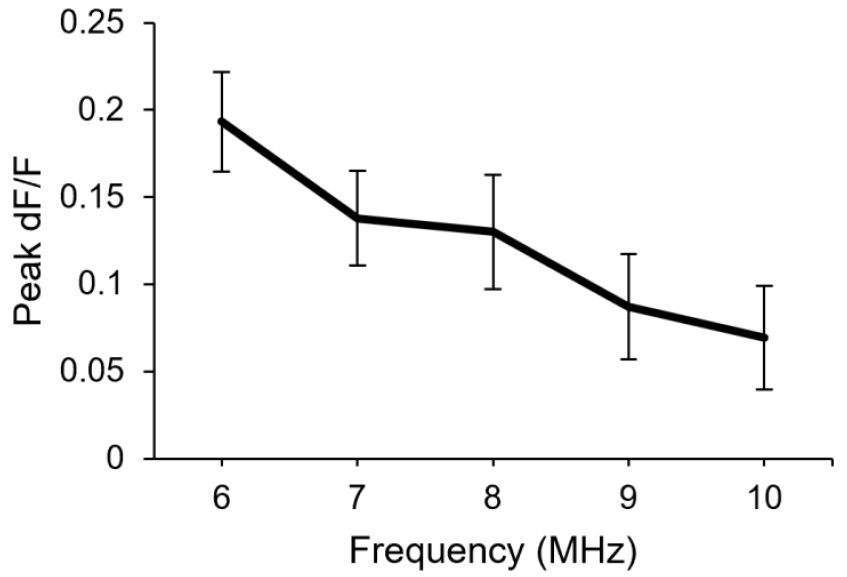
기존 연구 Oh et al.[8]과 Daque et al.[14]에서는 별세포의 TRPA1[Transient Receptor Potential cation channel, subfamily A1(TRPA1)] 채널은 7 MHz 이하의 주파수와 비교적 낮은(Ispta < 1W/cm2) 음향 강도의 초음파 자극에 반응하여 신경세포의 활성을 유도할 수 있음이 보고되었다. 이에 따라 개발한 변환자에서 해당 주파수 대역에서 칼슘 반응이 유도되는지 확인하기 위하여, 6 MHz부터 10 MHz까지의 서로 다른 주파수 대역을 가지지만 모두 0.2 MPa을 갖는 초음파 자극의 패턴을 별세포에 전도하였다. 결과적으로, 초음파 주파수가 낮아짐에 따라서 별세포의 칼슘 반응은 더 높아짐을 확인하였다(Fig. 11).
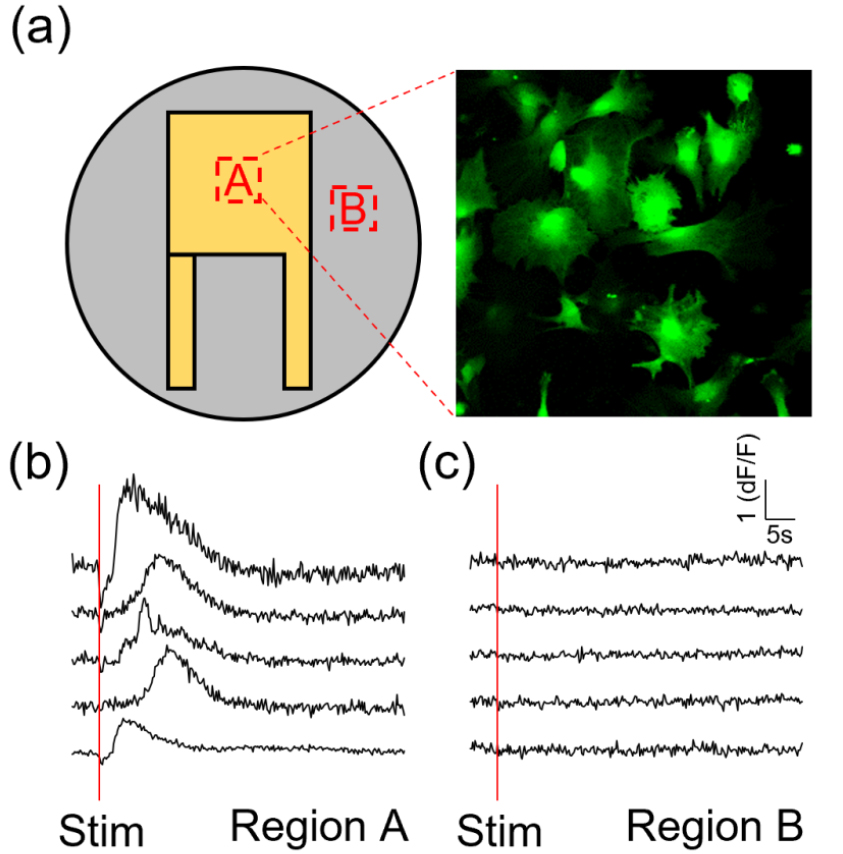
따라서, 커버슬립 초음파 변환자를 사용하여, 6 MHz, 0.2 MPa(Ispta < 1W/cm2)의 주파수와 저강도 초음파 자극을 사용하여 별세포의 칼슘 변화를 성공적으로 측정하였다. Fig. 12(a)에서 보는 바와 같이, 변환자 표면에 많은 별세포가 배양되었고, Fluo4-AM 칼슘 표지자를 통해 세포 내부 칼슘을 성공적으로 표지하여 공초점 현미경(LSM 900, Zeiss)으로 칼슘 반응을 관찰할 수 있었다. 획득한 세포의 반응이 초음파 자극에 대한 반응인지 검증하기 위해 초음파 신호가 발생하는 지역 A와 그렇지 않은 지역 B의 세포 내부 칼슘 반응을 측정하였다. 결과적으로, 지역 A에 배양된 별세포의 칼슘 반응은 지역 B에 배양된 별세포의 반응과는 달리 강한 흥분성 칼슘 반응이 유도되었으며[Fig. 12(b)], 초음파가 나오지 않는 지역 B에서는 칼슘 반응이 유도되지 않았다[Fig. 12(c)]. 따라서, 개발한 세포 배양 가능한 초음파 변환자를 통해 별세포를 성공적으로 변환자 표면에 배양하였고, 효과적으로 별세포의 초음파 자극에 따른 칼슘 반응을 유도할 수 있었다.
IV. 결 론
본 연구에서는 폴리머 소재의 압전 소자인 PVDF-TrFE를 이용하여 세포 배양이 가능한 초음파 변환자를 개발하였다. 개발한 초음파 변환자는, 기존의 뇌세포 자극용 초음파 변환자와는 달리, 세포를 변환자 표면에 배양할 수 있으며, 흡음 소재를 변환자 주변에 설치할 수 있어서 정확한 초음파 자극을 많은 양의 세포에 균일하게 전달하여 세포의 칼슘 반응을 수십개의 세포로부터 동시에 획득할 수 있다. 개발된 변환자를 이용하여, 초음파 자극에 민감하다고 알려져 있는 별세포를 성공적으로 배양할 수 있었고, 초음파 자극을 가하여 강한 흥분성 칼슘 반응을 형광 현미경을 통해 측정할 수 있었다.
본 연구에서 제안한 초음파 변환자는 6 MHz 주파수, 0.2 MPa의 음압을 가진 초음파 자극을 별세포에 전달함으로써 자극에 대한 별세포에서의 칼슘 반응을 세포 단계에서 측정할 수 있었다. 6 MHz 주파수의 초음파 자극은 비교적 두개골이 얇은 소동물의 뇌에서는 비침습적으로 소동물의 뇌세포를 자극할 수 있지만, 초음파 자극에 대한 세포 결과를 임상적으로 적용하기 위해서는 대동물에서 두개골을 통과할 수 있는 주파수인 1 MHz의 초음파 자극을 전달할 수 있는 변환자의 개발이 필수적이다.[14,15] 따라서, 변환자의 중심 주파수를 낮추기 위해서는 PVDF-TrFE의 두께를 증가시켜야 하지만, 압전성을 띄게 하는 폴링의 과정을 거치기 위해서는 수천 V의 초 고전압을 폴리머 소자 양단에 가해 주어야 한다. 이러한 고전압의 사용은 절연 붕괴 등 여러 기술적인 제약이 존재하게 되는데, PVDF-TrFE 변환자의 넓은 대역폭으로 인해, 지금과 같이 –6 dB 대역폭 내 낮은 주파수 대역을 사용한다면, 현재의 사용 주파수 제한을 극복할 수 있을 것으로 기대한다.