I. 서 론
II. 초음파 광간섭단층 촬영(OCT) 기반 다중 모달 영상 기술
III. 초음파 광음향 기반 멀티 모달 영상 기술
IV. 초음파 형광 영상 기반 다중 모달 영상 기술
V. 초음파 형광 시정수(Fluorescence life-time) 다중 모달 영상 기술
VI. 초음파 광학 분광 다중 모달 영상 기술
VII. 결론 및 향후 계획
I. 서 론
초음파 영상은 비침습적인 특성, 휴대성 및 실시간 영상 기능을 갖춘 영상 기법으로서, 의학 및 생명과학 분야에서 다양한 응용 분야에 사용되어 왔다.[1,2] 특히 의료 현장에서는 초음파를 통해 인체의 장기와 조직의 해부학적 정보나 혈류 속도와 같은 기능적 정보를 획득하는 데 유용하게 활용되었다.[1,2] 그러나 초음파 영상은 주파수에 따라 영상 깊이와 해상도가 결정되어, 의료 분야에서는 주파수에 따라 적용 범위가 달라지는 제약이 있다. 주파수가 높을수록 영상의 깊이가 제한되고, 주파수가 낮을수록 영상 깊이는 증가하지만 공간 해상도가 낮아지는 한계가 있다.[3]
이러한 한계를 극복하고 초음파를 통해 제공되는 진단 정보를 향상시키기 위해 광학 영상뿐만 아니라 컴퓨터 단층 촬영(Computed Tomography), 자기 공명 영상(Magnetic Resonance Imaging, MRI), 양전자 방출 단층 촬영(Positron Emission Tomography, PET) 또는 단일 광자 방출 컴퓨터 단층 촬영(Single-Photon Emission Computed Tomography, SPECT)과 같은 다른 영상 기법과의 다중 모달 영상 연구가 활발히 진행되고 있다.[4,5,6,7] 다중 모달 영상을 결합하면 각각의 영상 기법이 제공하는 장점을 상호 보완하여 조직의 해부학적, 기능적 및 분자적 특성을 종합적으로 제공할 수 있다.
예를 들어, 초음파-CT 다중 모달 영상은 초음파의 실시간 영상 기능과 CT 스캔의 상세한 해부학적 정보를 결합하여 최소 침습적 시술인 생검이나 바늘 삽입 등에 유용하게 활용된다.[5] 또한, 초음파-MRI 다중 모달 영상은 초음파의 실시간 영상과 MRI의 우수한 연조직 대비 및 다중 평면 기능을 결합하여 뇌 종양이나 근골격계 이상과 같이 초음파로는 평가하기 어려운 구조의 시각화를 개선하는 데 활용된다.[4,6] 초음파-PET 또는 초음파-SPECT 다중 모달 영상은 초음파에 기능적 분자 영상 기술을 결합하여 특정 분자나 물질의 위치를 파악하여 암과 같은 질병의 탐지 및 특성화에 활용된다.[5,7]
특히, 초음파와 광학 영상의 다중 모달 영상 기술은 다른 영상 기법과의 결합 기술에 비해 활발히 연구되고 있다. 초음파는 고주파 음파를 사용하여 실시간 영상을 제공함으로써 조직 구조와 혈류를 시각화할 수 있다. 그러나 공간 해상도가 제한적이며 조직의 미세 구조나 분자 구성에 대한 자세한 정보 제공이 어렵다. 반면 광학 영상 기법은 빛을 활용하여 조직을 미세 수준에서 조사하여 마이크로미터 단위 분해능을 가지는 고해상도 영상과 더불어 기능 및 분자 정보를 제공하지만 표면만 영상이 가능하거나 혹은 밀리미터 깊이까지만 영상이 가능하다는 한계가 있다. 따라서 초음파 광학 다중 모달 영상 기술로서 초음파의 실시간 영상 기능과 광간섭 단층 촬영(Optical Coherence Tomography, OCT), 광음향 영상(PhotoAcoustic Imaging, PAI), 형광 영상(Fluorescence Imaging, FI), 형광 시정수 영상(Fluorescence LIfetime-resolved Imaging, FLI), 분광 영상(MultiSpectral Imaging, MSI) 등 다양한 광학 영상 기법과 결합하여 고해상도 및 기능 정보를 동시에 획득하는 영상 기술들이 개발되었다(Table 1).
Table 1.
Recent ultrasound-optical-based multimodal imaging technologies for biomedical applications.
| Reference | Fused optical modalities | Applications | Remarks |
| Yin et al.[9] | OCT | Intravascular imaging |
Arranged ultrasonic/OCT system side by side within the probe |
| Liang et al.[10] | OCT, FI | Intravascular imaging |
3D image composition using a linear stage |
| Fedorov et al.[11] | OCT | Diagnosis of skin cancer |
Acquired ultrasound-optical images at the same field of view using an acoustic mirror |
| Kang et al.[12] | OCT | Measurement of elasticity of eye |
Induce tissue displacements using an acoustic radiation force & Measure the displacements using OCT |
| Yang et al.[15] | PAI, OCT | Diagnosis of ovarian tumor |
Applied synthetic aperture focusing and coherence factor weighting |
| Wei et al.[16] | PAI | Intravascular imaging | Utilized a ring-type ultrasound transducer |
| Yang et al.[17] | PAI | Endoscopy |
Rotational radial scanning using a magnetic coupling |
| Wang et al.[18] | PAI | Diagnosis of skin |
Bimorph transducer that combined PZT and PVDF |
| Park et al.[19] | PAI | Preclinical evaluation (mouse tail) |
Single-element transparent ultrasound transducer |
| Chen et al.[20] | PAI, FI | Phantom evaluation |
Array-type transparent ultrasound transducer |
| Valimukhametova et al.[21] | FI | HEK-293 | - |
| Yao et al.[22] | FI | Preclinical evaluation (mouse) |
FI imaging at deep depth (centimeter-level) |
| Snyder et al.[23] | FI | Assessment of pancreatic cancer progress |
Proposed non-invasive method for evaluating drug in preclinical stage |
| Estrada et al.[24] | FI | Brain imaging |
Observed neural and cortical responses without surgery |
| Rauschendorfer et al.[25] | FI | Intravascular imaging |
Estimated optical attenuation coefficient per frame |
| Kim et al.[26] | FI | Phantom evaluation & brain tissue (rat) imaging |
Generated a microbubble layer using ultrasound & Enhanced imaging depth of confocal microscopy |
| Gorpas et al.[27] | FLI | Intravascular imaging | Rotational pullback |
| Ma et al.[28] | FLI | Intravascular imaging | Helical pullback |
| Fatakdawala et al.[29] | FLI, PAI | Oral cancer diagnosis (hamster) |
Integrated an ultrasound transducer, fiber for PAI, and fiber for FLI in a single probe |
| Kim et al.[30] | MSI | Diagnosis of rectal cancer |
MSI (28 wavelength) & acoustic radiation force-based mechanical property analysis |
| Kim et al.[31] | MSI | Diagnosis of rectal cancer |
MSI (15 wavelength) & backscattered signal-based mechanical property analysis |
본 논문은 이러한 초음파 광학 다중 모달 영상 기술에 대한 최신 연구 동향을 소개하고, 의학 및 생명과학 분야에서의 응용에 대해 논의한다.
II. 초음파 광간섭단층 촬영(OCT) 기반 다중 모달 영상 기술
초음파 광간섭단층촬영(OCT) 다중 모달 영상 기술은 초음파와 광간섭단층촬영 영상 기법의 장점을 결합하여 생물학적 조직과 구조에 대한 포괄적인 정보를 제공할 수 있다. 초음파 영상은 음파를 활용하여 내부 구조의 실시간 영상을 생성하지만 고해상도 영상에 있어서는 제한적이다. 한편 광간섭단층촬영은 근적외선(850 nm 혹은 1,050 nm 대역)을 사용하여 조직에서 반사되어 오는 빛을 광간섭을 이용하여 깊이 정보로 변환하고 시각화하는 기술로서 조직의 고해상도 단면 영상을 생성할 수 있지만 최대 영상 깊이가 밀리미터 단위로 국한되어, 일반적으로 안과에서 망막 층을 시각화하는 등의 조직 표면 영상으로의 활용이 제한되어 왔다.[8]
이러한 한계를 극복하기 위해 초음파와 광간섭단층촬영을 결합한 다중 모달 영상 기술이 개발되었다. 이러한 조합을 통해 특히 안과, 피부과, 심혈관 영상과 같은 분야에서 조직과 구조의 영상을 개선할 수 있음을 보여주었다. 관련 연구로 혈관 내 영상을 위해 광간섭단층촬영 프로브에 초음파 변환자(40 MHz, 0.16 mm2 구경)를 결합하고 토끼 대동맥(in-vitro) 영상을 획득하여, 광간섭단층촬영으로는 죽상 동맥경화 진단에 중요한 얇은 판막의 두께 정보를 제공하면서 초음파로는 판막 내 지질군(lipid pool)을 시각화할 수 있어 동시에 상보적인 정보를 제공함으로써 죽상 동맥경화증 진단에 필요한 비용과 시간을 줄일 수 있는 가능성을 보였다.[9] 또한 초음파 광간섭단층촬영에 형광 영상을 결합한 혈관 내 다중 모달 영상 시스템도 개발되어 광간섭단층촬영, 초음파가 제공하는 상보적 구조 정보와 더불어 형광 영상을 통해 분자적 정보를 제공하여 취약성 경화반 진단에 도움을 줄 수 있었다.[10]
피부암 진단과 관련해서는 광간섭단층촬영, 초음파 뿐만 아니라 라만 스펙트로스코피를 결합하여 정확한 비침습적 진단과 더불어 여러 병변 깊이를 측정할 수 있는 시스템이 개발되었다(Fig. 1). 구체적으로 광간섭단층촬영은 1 mm 깊이 이하의 작은 병변에 대해 구조적, 깊이 정보를 제공하고 초음파(18 MHz)는 4 mm 이상의 두꺼운 병변 깊이에 대해 침습 깊이를 측정할 수 있게 하며 라만 스펙트로스코피는 선별된 지점의 화학 성분 분석을 통해 흑생종의 악성/양성 여부를 판별할 수 있게 했다.[11]
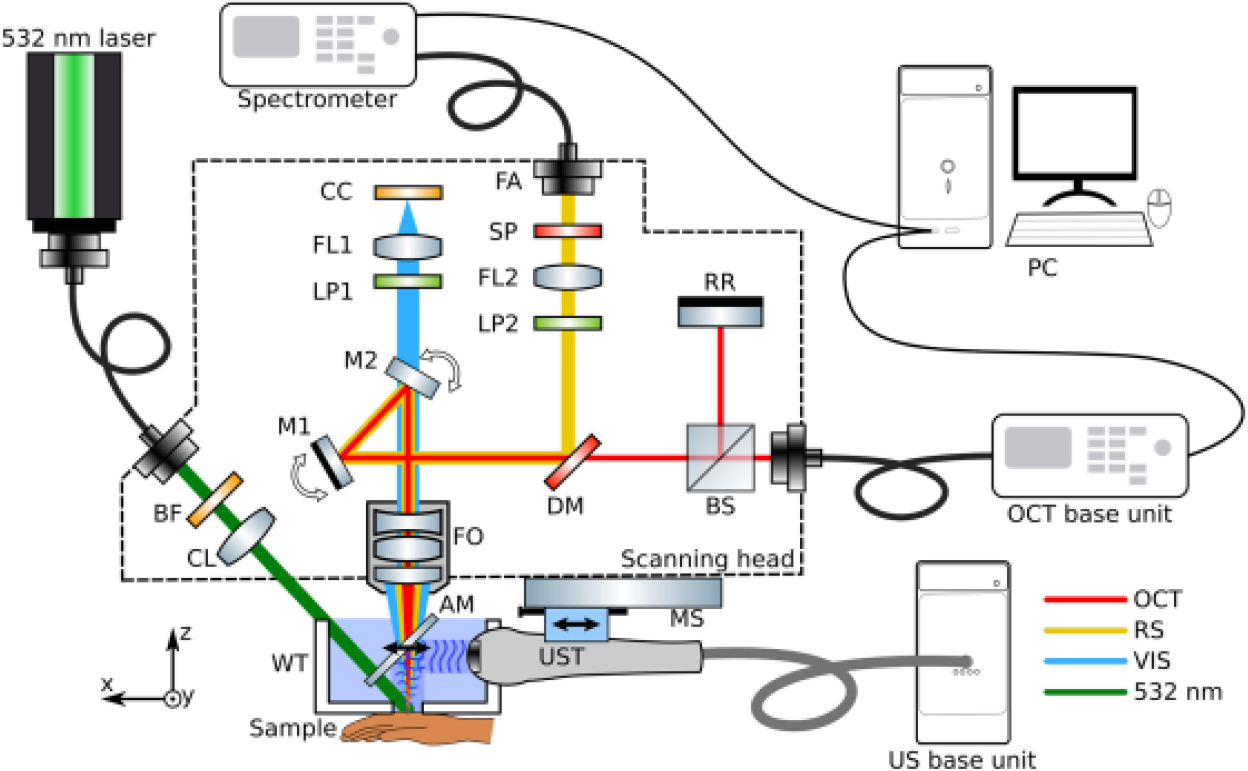
Fig. 1.
(Color available online) The experimental setup for US-OCT multimodal imaging.[11] AM, acoustical mirror; BF, bandpass filter; BS, beam splitter, CC, camera chip, CL, collimating lens; DM, dichroic mirror; FA, fiber adapter; FL, focusing lens, FO, focusing objective; LP, long pass filter; M, galvo mirrors; MS, motorized stage; OCT, optical coherence tomography; RR, retroreflextor; SP, shortpass filter, UST, ultrasound transducer; WT, water tank.
더 나아가 초음파가 비접촉적으로 기계적 힘을 일으켜 조직 변위를 유도할 수 있음을 이용하여 2차원 초음파 변환자(3.5 MHz)와 광간섭단층촬영을 결합한 초음파 방사힘 기반 광간섭 단층 탄성영상(Optcial coherence elastography) 시스템이 개발되었으며 이를 이용해 토끼 눈에서 각막, 망막 등 안구 조직의 단면 구조뿐만 아니라 기계적 특성을 고해상도로 특성화할 수 있었다.[12]
초음파 광간섭단층촬영 다중 모드 영상에서는 초음파 영상과 광간섭단층촬영 영상을 동시에 또는 순차적으로 획득한 다음 융합하여 병합된 영상을 생성하고, 이렇게 병합된 영상은 조직 형태, 구조적 무결성 및 병리학적 변화를 관찰하는데 정확한 정보를 제공한다. 또한 초음파와 광간섭단층촬영과의 통합은 임상에서 다양한 정보 제공할 수 있다. 예를 들어, 안과에서 초음파 광간섭단층촬영은 망막 구조와 혈류에 대한 자세한 정보를 이용하여, 황반변성이나 당뇨병성 망막증과 같은 질환의 진단 및 관리에 적용되었고, 심혈관 영상에서는 혈관벽, 플라크, 스텐트 배치의 시각화를 향상시켜 관상동맥 질환이나 기타 심장 질환을 진단하는데 사용되었다.
따라서, 초음파 광간섭단층촬영 다중 모달 영상 기술은 조직과 구조에 대한 보다 포괄적이고 상세한 평가를 제공함으로써 질병 진단에서 정확도를 개선할 수 있어, 그 활용도가 확대되고 있다.
III. 초음파 광음향 기반 멀티 모달 영상 기술
초음파 광음향 다중 모달 영상 기술은 초음파 영상과 레이저의 물질의 광학 흡수 과정에서 발생한 초음파를 시각화 하는 광음향 영상 기법을 결합하여 해부학적 구조를 시각화하는 기술이다. 광음향 영상은 짧은 레이저 펄스가 조직에 흡수될 때 음파가 생성되는 광음향 효과를 이용하는데, 생성된 음파는 초음파 트랜스듀서에 의해 감지되어 빛을 선택적으로 흡수한 조직의 고해상도 영상이 생성된다.[13] 광음향 영상은 조직의 광학 흡수 특성에 민감하기 때문에 레이저 광원의 파장대에 따라, 혈액, 멜라닌 또는 지질과 같은 다양한 조직 구성 요소의 빛 흡수 차이에 따라 조직의 구성 및 분자 정보를 시각화 할 수 있다.[14]
초음파 및 광음향 기반 다중 모달 영상 기술을 통해 초음파의 실시간 영상, 심부 조직 침투, 해부학적 정보를 획득하고, 광음향 영상의 고해상도 기능 및 분자 정보를 획득할 수 있어, 이러한 조합을 통해 영상 기능이 향상되어 조직 형태, 혈관 및 기능에 대한 정보를 동시에 획득할 수 있다. 초음파 광음향 다중 모달 영상 기법의 주요 응용 분야로는 종양학, 심혈관 영상, 신경 영상, 피부 영상등 다양하게 사용되고 있다. 예를 들어 종양학에서는 종양 혈관을 시각화하고, 종양 산소 공급을 평가하고, 종양 생검 또는 중재를 안내하는데 이 기술을 사용되었다. 심혈관 영상에서는 플라크 구성에 대한 자세한 정보를 제공하고, 심근 관류를 평가하거나, 혈류 역학을 시각화하는데 적용되었고, 마지막으로 피부 영상을 통해 피부 조직 형태와 혈관에 대한 정보를 획득하여, 피부 병변과 피부암을 진단하는데 그 정확성을 높이는데 기여하였다.[15,16,17,18,19,20]
예를 들어 초음파, 광음향 그리고 OCT가 결합된 내시경 시스템은 전임상, 임상 시험을 통해 구조적 정보(초음파)와 광흡수와 관련된 혈관 정보(광음향)를 동일시야로 제공함으로써 난소암 검출 및 특성화에 도움을 줄 수 있음을 보였다.[15] 이 외에도 여러 연구에서 광음향 현미경, 초음파 영상 시스템을 작은 프로브 내에 결합하여 광흡수, 조직 구조를 포함하는 상보적인 정보를 고해상도로 동시에 제공할 수 있는 소형 내시 영상 시스템들이 소화기 진단 및 혈관 내 영상 진단 정확도를 향상시킬 수 있는 도구로서 개발되었다.[16,17] 피부 진단과 관련하여서는 단일 변환자로 깊은 영상 깊이, 높은 신호 민감도를 달성하기 위해 lead zirconate titanate(PZT)와 Polyvinylidenefluoride(PVDF)가 결합된 bimorph 변환자가 개발 및 적용되어 깊은 영역까지의 피부 구조와 피하 혈관을 고해상도로 함께 관찰할 수 있었다.[18] 최근에는 변환자 제작 기술의 발전과 함께 투명 초음파 변환자(Fig. 2)가 개발되어 광음향 영상을 위한 레이저 조사가 초음파 변환자를 통해 이루어지는 새로운 다중 모달 영상 시스템이 개발된 바 있다.[19,20]
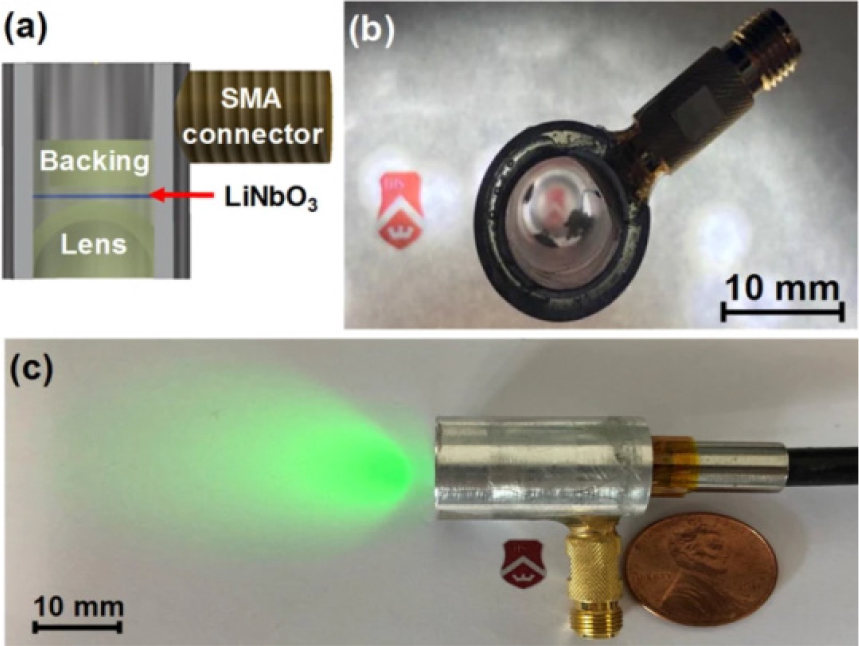
Fig. 2.
(Color available online) (a) Schematic cross section and (b) photograph of the optically transparent focused ultrasound transducer developed for both PA and US imaging; (c) Photograph showing light propagating through the transducer.[19]
이와 같이 초음파 광음향 다중 모달 영상 기술은 초음파와 광음향 영상의 강점을 결합하여 진단 정확도를 개선하는 데 가능성을 보여주고 있고, 더 나아가 의료 현장에 적용하기 위해 더 진보적인 시스템과 영상 분석에 관련된 다양한 연구들이 활발하게 진행되고 있다.
IV. 초음파 형광 영상 기반 다중 모달 영상 기술
초음파 형광 영상 기반 다중 모달 영상 기술은 초음파 영상과 형광 영상 기법을 결합하여 생물학적 구조뿐만 아니라, 분자 정보 등 다양한 정보를 제공한다. 형광 영상은 형광 프로브를 사용하여 조직 내의 특정 분자 표적이나 과정을 영상화하는 기술로써, 형광 프로브가 특정 파장의 빛에 여기될 때 방출하는 형광 빛을 검출하여 표적 분자 또는 세포 활동을 감지하고, 위치를 파악하는데 사용된다. 초음파 형광 영상 기반 다중 모달 영상 기술에서는 형광 프로브를 목표 조직에 투여하거나 적용하고, 그런 다음 초음파를 사용하여 해부학적 구조를 실시간으로 관찰한다. 이와 동시에 형광 영상을 통해 목표에 대한 분자 영상을 수행한다.[21,22,23,24,25]
이 다중 모달 영상 기술의 응용 분야는 종양학, 심장학, 신경학, 분자 생물학 등 다양한 분야에 걸쳐 광범위하다. 예를 들어 종양학에서는 이 기술을 사용하여 종양 특이적 분자 표적을 탐지 및 국소화하고, 종양 관류를 평가하고, 치료 반응을 관찰할 수 있다. 심장학에서는 혈관 내피 기능, 플라크 구성, 심근 생존율 평가에 도움을 줄 수 있다. 신경학에서는 뇌 기능, 신경 활동 및 특정 바이오마커의 분포를 시각화하는 데 도움을 줄 수 있다.
질소 함유 그래핀 양자점(Nitrogen-containing Graphene Quantum Dots, NGQD)을 이용한 영상 및 감지 기술은 초음파 형광 영상 기반 다중 모달 영상 기술의 대표적인 예시 중 하나이다.[21] HEK-293 세포의 내부에 소량의 금속이 도핑된 50 nm 이하의 그래핀을 삽입하여 효과적으로 세포 분석에 대한 영상을 수행하게 되는데 NGQD는 혈관 팬텀, 아가로스 겔, 닭가슴살 조직에서 기존 방법에 비해 향상된 초음파 신호를 획득하여 분석할 수 있으며, 동시에 고도로 정밀한 형광 추적을 가능하게 하였다.
기존의 초음파 형광 결합 영상에서는 조직에서의 높은 산란 특성으로 인해 공간 해상도에 대한 제한이 있으며, 생체 내에서 안정적으로 작용되는 근적외선 조영제에 대한 기술 결함과 생체 내부에 대한 데이터 부족으로 인한 한계가 있었다. 그러나 최근 센티미터 깊이의 조직에서 고해상도의 형광 영상 구현을 위한 새로운 영상 기술인 초음파 형광 전환 영상 기술(Ultrasound-Switchable Fluorescence, USF)이 제안되었다.[22] 쥐 모델에 대해 센티미터 깊이에서의 고해상도 초음파 전환 형광 영상을 성공적으로 시행하였으며, 국부 주사를 통한 쥐의 유방 종양에서 USF 영상을 구현하였다. 정맥 주사를 통해 쥐의 비장에서 생체 내 종양 추적에 성공하였으며, 결과적으로 USF는 조영제를 통해 신호가 생성되며 심부 조직의 조영제에 대한 높은 감도와 특이성을 지니고 있기에 비특이적 배경 광자에 대한 영향을 받지 않는 상태로 조직 내부의 초음파 분석을 성공적으로 수행할 수 있다.
췌장 종양 크기 및 성장 속도를 평가하기 위한 생체 내 영상 연구에서도 초음파 형광 영상 기법이 사용되었다.[23] 적색 형광 단백질 발현을 위해 XPA-1 췌장암 세포를 마우스 췌장에 이식하여 1주 혹은 그 이상 종양을 성장시켰다. 이러한 기술은 실시간으로 종양 성장 속도, 전이 시간 경과, 치료법에 대한 종양 반응과 같은 사후 분석으로는 얻을 수 없는 정보를 제공하며, 높은 감도로 마우스 모델에서 췌장 종양을 탐지, 분석할 수 있었다.
최근에는 형광 영상이 경두개 초음파 자극 시스템과 결합되어 초음파 자극에 의한 형광 반응을 실시간, 고해상도로 관찰하는 기술로서 사용되었다.[24] 3 MPa ~ 5 MPa의 상대적으로 낮은 초음파 압력을 사용하였으며, 나노초 범위의 형광 영상이 가능하여 짧은 초음파 펄스의 물리적 효과에 대해 신속하게 형광 영상이 가능하다. 결론적으로 낮은 강도에서 초음파가 뇌에 작용하는 물리적 기전 이해 과정에서 초음파 조사 시 발생하게 되는 뇌 활동 및 열 효과에 대한 직접적인 시각화의 부족을 신경 활동 형광 영상을 통해 해결하는 방법을 제공했다.
혈관 내 형광 영상은 혈관 질환 특이적 형광 물질을 이용하는 혈관 병리학 검사 방법 중 하나로서 구조적 정보를 제공하는 혈관 내 초음파 영상과 함께 분자적, 병리생리학적 정보를 제공해 함께 사용된다. 하지만 혈액에 의한 형광 신호 감쇠가 심해 형광 신호를 정량화하는 것이 어렵다. 이에 혈관 내 초음파-형광 영상 획득 시에 프로브와 함께 형광 물질이 코팅된 가이드 와이어를 혈관 내에 삽입하여 가이드 와이어로부터의 형광 신호를 이용해 실시간으로 형광 신호의 감쇠를 보정하는 기법이 제안되었다(Fig. 3).[25] 돼지 관상 동맥과 팬텀의 최대 1 mm 거리에서 획득된 목표 신호에 대해 최대 11 % 미만의 오류에 대한 개선을 보여주었으며, 이 방법을 통해 생체 내 혈관 내 영상 정확도를 향상시킬 수 있음이 확인되었다.
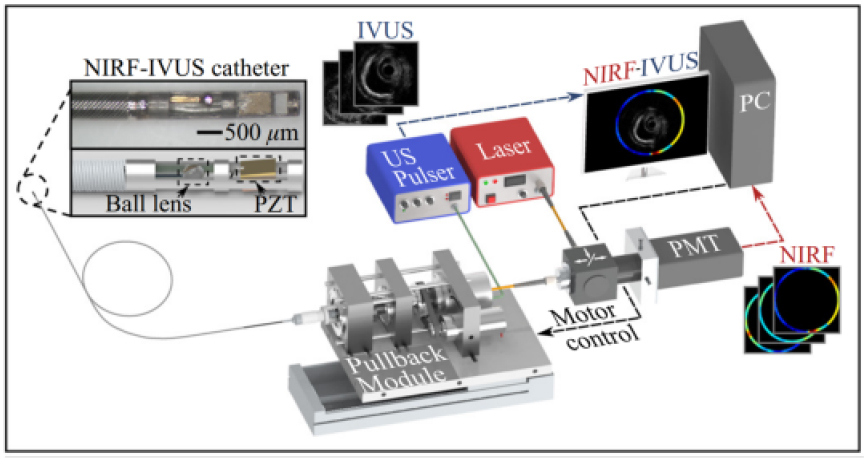
Fig. 3.
(Color available online) Illustration of Near- Infrared Fluorescence (NIRF) imaging setup.[25]
이외에 최근에는 초음파와 공초점 형광 현미경을 결합하여, 공초점 형광 현미경의 영상 깊이를 개선하는 기술이 보고되었다. 본 연구에서는 초음파를 조직에 인가하면 공기 방울 층이 생성되어, 빛의 조직 내에서의 산란을 줄일 수 있음을 보였고, 개발된 기술을 이용해 공초점 현미경의 영상 깊이의 6배 이상 개선할 수 있는 것을 보여주었다.[26]
이와 같이 지금까지 초음파와 광학 형광 영상 기법들과의 결합을 통해 다양한 다중 모달영상 기술이 개발되었다. 이 영상 기술을 통해 조직 내 분자 및 세포들의 현상을 비침습적으로 관찰할 수 있었으며, 초음파 영상의 단점인 고해상도 분자 영상에서의 그 한계를 극복할 수 있는 것을 보여주었다.
V. 초음파 형광 시정수(Fluorescence life-time) 다중 모달 영상 기술
초음파 형광 시정수 다중 모달 영상은 초음파와 형광 시정수 영상의 결합을 통해 생체 내부의 해부학적 정보와 세포 수준에서의 분자 현상을 실시간으로 관찰하고 정량화할 수 있는 영상 기법이다. 형광 시정수 영상은 형광 프로브마다 다른 여기 소멸 시간을 측정하여 시각화하는 방법으로 형광 영상에 비해 광원 및 외부 밝기의 변화, 광표백의 변화에 대해 덜 민감하며 여기조직의 생화학적 특성과 형광 프로브 주변의 환경 및 분자와의 상호 작용에 대한 정보를 제공한다. 이러한 다중 모달 영상 기법을 통합함으로써 생물학적 시스템에 대한 이해를 증진하고 질병의 조기 발견과 특성화를 가능하게 한다.
초음파 형광 시정수 다중 모달 영상은 종양학, 심혈관 영상, 신경학 등 다양한 분야에서 유망한 응용 분야로 입증되었다. 암 연구에서는 종양 이질성을 확인하고 치료 효과를 평가하며, 외과적 수술의 정밀도를 향상시키기 위해 종양 병변을 영상화하는 데 사용되었다. 심혈관 영상에서는 혈관 기능 평가, 플라크 특성화, 치료 중재 모니터링 등의 가능성을 제시하였고, 또한 신경학 분야에서는 뇌 기능, 신경 퇴행성 장애, 중추 신경계로의 약물 전달 효과를 관찰하는 데 적용되고 있다.
예를 들어 초음파 형광 시정수 다중 모달 영상 기술을 활용하여 협심증의 원인인 협착증을 측정하였다. 형광 시정수 영상을 통해 얇은 섬유질 덮개가 있는 플라크를 감지하고, 지질이 풍부하고 염증이 있는 병변을 식별할 수 있었다. 이 방법은 형광 시정수 값을 측정하여 정량적으로 플라크를 영상화하는 것이므로, 형광체의 농도나 거리에 민감한 형광 빛의 세기 측정에 대한 의존성을 없앴다. 또한 혈관 내 초음파 영상을 사용하여 관상 동맥 플라크의 구조적 특성을 평가하였고, 단면 내강 면적, 내막층 두께, 플라크 분포, 혈관의 외부 리모델링 등의 형태학적 특징을 영상화하고 정량화하였다. Fig. 4와 같이 두 가지 영상 시스템을 하나의 카테터에 결합함으로써 혈관 내 질환에 대한 생화학적 및 형태학적 정보를 종합적으로 얻었으며 이를 통해 종합적인 혈관 내 진단을 수행하였다.[27,28]

Fig. 4.
(Color available online) Photograph of the US-FLIM multimodal imaging catheter: IVUS transducer and side-viewing fiberoptic integrated in a parallel design.[28]
또한, 초음파 형광 시정수와 광음향 영상 시스템을 결합하여 구강암 진단에 적용되었다. 이 다중 모달 영상을 사용하여 정상 조직보다 혈관이 많은 종양 영역을 광음향 영상으로 검출하고, 초음파 후방 산란 계수 현미경(Ultrasound BioMicroscope, UBM) 기술을 사용하여 기저 조직의 미세 구조와 두께에 대한 정보를 얻었다. 동시에 조직 내 Nicotineamide Adenine Dinucleotide(NADH) 결합/비결합 상태와 콜라겐 함량의 변화로 인한 형광 시정수 차이를 영상화하여 구강암 진단의 정확도를 향상시킬 수 있었다.[29]
이와 같은 초음파 형광 시정수 다중 모달 영상 기술은 심혈관 영상, 암 진단 등 다양한 분야에 적용되어 우수한 성과를 보여주었다. 특히, 이 영상 기술을 통해 조직의 환경과 구조적 정보를 동시에 정량적으로 영상화할 수 있으며, 이를 통해 앞으로의 바이오 메디컬 분야에서의 활용 가능성이 크게 확대될 수 있음을 보여주었다.
VI. 초음파 광학 분광 다중 모달 영상 기술
초음파 광학 분광 영상 기반 다중 모달 영상은 초음파 영상과 광학 분광 영상의 결합을 통한 영상 기법이다. 분광 영상 기법은 한 샘플에 여러 가시광선 파장대역(400 nm ~ 700 nm)의 빛을 조사하고 반사되는 빛을 기록하여 조직의 성질에 따라 다른 분광 지표를 측정하고 병변 또는 생물학적 현상을 정량화할 수 있는 기술이다. 이러한 분광 영상을 통해 조직의 산소 공급, 혈류, 대사 활동, 특정 바이오마커 또는 조영제의 분포에 대한 정보를 시각화할 수 있다.
현재 초음파 광학 분광 다중 모달 영상 기술은 다양한 질병 진단 및 연구에 활용되고 있다. 특히, 이 영상 기법을 통해 종양 위치 정밀 판독과 치료 반응 관찰이 가능하다. 예를 들어 Fig. 5와 같이 초음파 분광 영상 다중모달 현미경을 개발하여 수술 중 생검 시 초음파 B-mode 영상을 사용하여 수술 부위에서의 깊이 방향 분포를 감지하고, 초음파 방사력 영상 기법을 활용하여 조직의 기계적 특성을 분석하여 종양의 분포를 세밀하게 분석하였다.[30] 또한 분광 영상 및 분석 기법을 통해 생검 조직의 표면에서 종양 분포를 정량화하여 종양 제거 수술의 정밀도를 향상시켰다. 이후 초음파 분광 영상 다중 모달 내시경을 개발하여 내시경 진단 시 종양의 깊이 방향 및 표면에서의 분포도를 정량화하는 데 사용되어 암 진단의 정확도를 향상시켰다.[31] 해당 연구에서는 고주파 초음파 B-mode 영상을 통해 조직의 해부학적 정보를 획득하고, 초음파 후방산란 계수(Backscattering coefficient) 영상을 통해 종양의 위치를 정밀분석 하였다. 더 나아가, 분광 영상을 이용해서 종양의 대장 표면 분포도를 정량적으로 분석하였다.
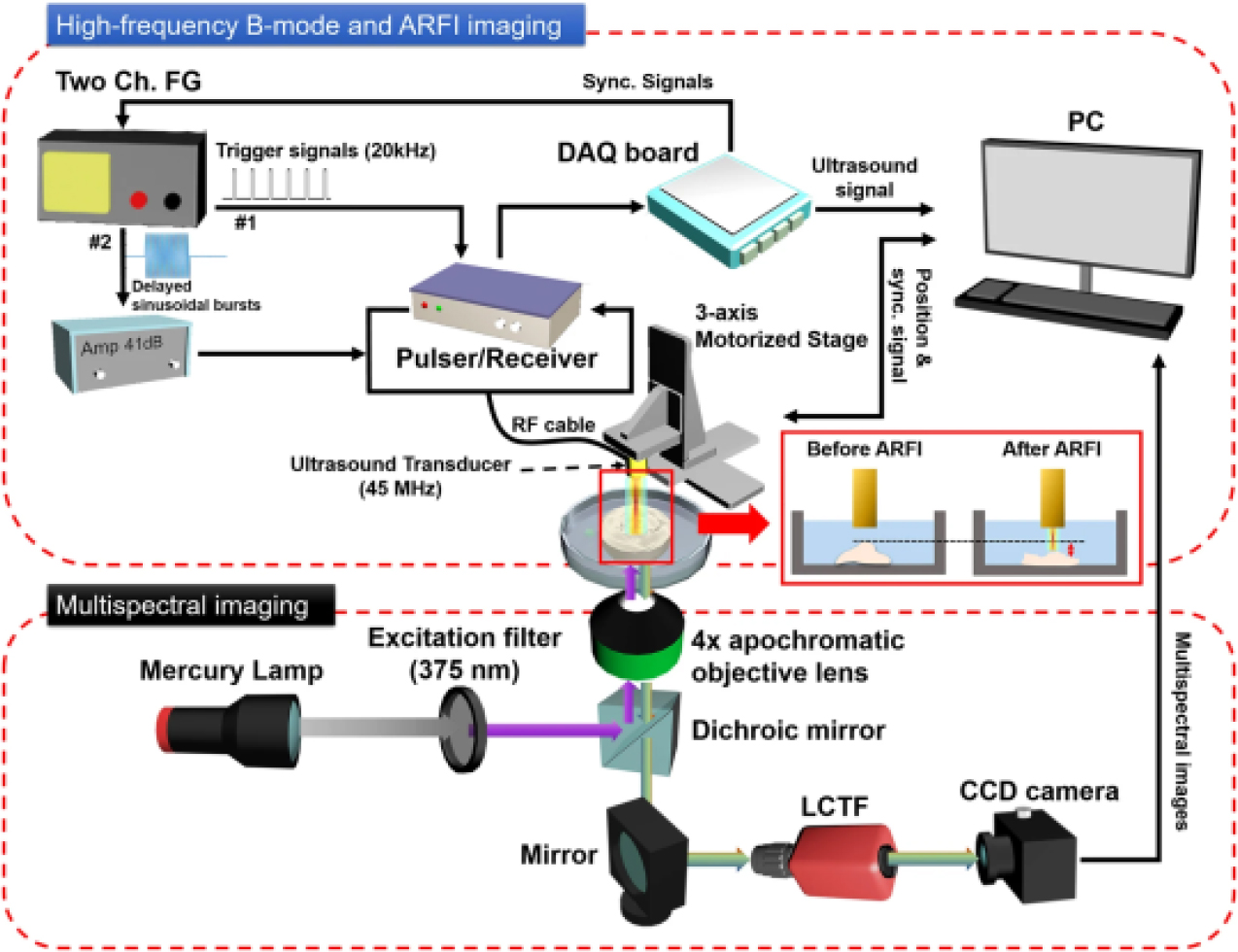
Fig. 5.
(Color available online) Block diagram of a US-multispectral imaging multimodal biomicroscopic system.[30]
초음파 광학 분광 멀티 모달 영상 기술은 치아우식증 검출에도 적용될 수 있다. 고주파 초음파 영상을 이용해서 치아 우식증의 침투 깊이를 정량화하고[Fig. 6(a)], 광학 분광 영상을 이용하여 획득한 각 파장대 별로 획득한 영상을 이용해 초기 치아 우식증을 검출하고 경계 부분을 검출할 수 있다[Fig. 6 (b)]. 초음파 영상에서 치아 우식증으로 의심되는 영역에서 밝은 영역 층 사이에 어두운 영역이 나타나는 것을 확인할 수 있다[Fig. 6(a) 화살표]. 반면에 분광 영상에서는 파장대 별로 치아 표면에 있는 치아 우식증 부분과 정상인 부분의 영상 밝기 변화 패턴에서 차이가 나는 것을 확인할 수 있다. 또한 이런 분광 영상에서의 파장별 밝기 변화 차이를 이용해 치아 우식증을 보다 정확하게 분석하기 위해 인공지능 기술이 적용될 수 있다. Fig. 7은 그 분광 분석 인공지능 네트워크와[Fig. 7(a)] 그 분광 분석 분할 결과를[Fig. 7(c)] 보여 준다. 분광 분석 분할 영상에서 빨간색 부분은 심한 치아 우식증, 파란색 부분은 초기 치아 우식증, 그리고 녹색은 정상 치아를 각각 나타낸다. Table 2에서 정량적으로 결과를 보듯 분광 영상이 기존 백색광 영상만 활용하는 것보다 더 좋은 결과를 보이며 흥미롭게도 백색광, 분광, 형광 영상이 더해질수록 정확도가 증가하였다. 이와 같은 분석 결과는 단순히 백색광 영상을 활용하는 것보다 분광 영상을 활용하는 것이 더 정량적으로 치아 우식증 영역을 검출할 수 있으며, 질병에 대한 더 많은 상보적인 정보 조합을 얻을수록 딥러닝 모델의 성능을 개선할 수 있음을 보여 주었다.
Table 2.
Segmentation results (intersection of union) from two deep learning models according to different combinations of multispectral images.
| Model |
White (W) |
Multi Spectral (S) |
Fluorescence (F) | W+F | S+F | W+S+F |
| U-Net[32] | 82.2 | 82.6 | 80.4 | 85.4 | 85.6 | 85.6 |
| SAU-Net[33] | 81.4 | 82.4 | 79.5 | 83.9 | 84.9 | 85.4 |
결론적으로 초음파 광학 분광 영상 기반 다중 모달 영상기술은 암 진단 및 치아 우식증 조기 진단에서 질병의 침투 깊이, 표면 분포를 정량적으로 분석하는데 그 가능성을 보여주었다. 따라서 이러한 결과들은 이 영상 기술이 다양한 질병 진단에 적용되어 진단 정확도를 향상 시키는데 유용한 정량적 영상 기법으로써 활용될 수 있다는 점을 보여준다.
VII. 결론 및 향후 계획
본 논문에서는 초음파 광학 기반 다중 모달 영상 기술에 대한 지금까지의 최신 기술과 의학 및 바이오에서의 응용에 대한 전반적인 내용에 대해 소개한다. 지금까지 연구들에서 도출된 결과에서 나타난 바와 같이 초음파를 광학 영상 방식과 통합하면 상호 보완적 효과를 낼 수 있는 정보를 얻을 수 있다. 실시간 영상, 구조적 세부 사항, 기능 정보 및 분자 특이성을 결합함으로써 초음파 광학 다중 모달 영상은 향상된 진단 기능, 중재 지침 개선 및 생물학적 과정에 대한 심층적인 이해를 제공할 수 있다. 초음파 광학 다중 모드 영상에 사용되는 특정 기술과 접근 방식은 연구 또는 임상 적용에 따라 달라질 수 있다. 또한 최근에는 인공지능 기반 영상 처리 알고리즘의 지속적인 발전으로 이 통합 영상 접근법의 가능성과 임상적 유용성이 계속 확대되고 있다.
이와 같이 초음파 기반 다중 모달 영상은 진단 정확도를 높이고 치료 계획을 수립하는데 있어서, 다양한 의료 상태에 대한 보다 포괄적인 이해를 제공할 수 있는 잠재력을 가지고 있다. 따라서 다양한 영상 기법의 강점을 결합하여 근본적인 병리를 보다 완벽하게 파악할 수 있는 새로운 초음파 기반 다중 모달 영상 기술이 개발된다면, 환자 진단 및 치료에 유용하게 적용될 수 있을 뿐만 아니라, 생명 현상을 밝히는데 있어서 다양한 정보를 획득할 수 있어, 신뢰성을 더욱 높일 수 있을 것이다.






